Kierownik projektu
:
prof. dr hab. Krystyna Bieńkowska-Szewczyk
Uniwersytet Gdański
Panel: NZ1
Konkurs
: MAESTRO 2
ogłoszony
ogłoszony 15 grudnia 2011 r.
Celem projektu było badanie dróg szybkiego przemieszczania się wirusów pomiędzy komórkami. Wirusy mogą zakażać wrażliwe komórki od zewnątrz, poprzez wiązanie z receptorami obecnymi na powierzchni komórki i stopniowe wnikanie do jej wnętrza. Tam następuje otwarcie cząstek wirusowych, uwolnienie materiału genetycznego (DNA lub RNA), który jest powielany w procesie replikacji, produkcja białek wirusowych i składanie nowopowstałych cząstek wirusowych, które następnie wydostają się na zewnątrz i zakażają następne komórki. Jednak niektóre wirusy potrafią też przenikać do sąsiednich komórek bez uwalniania do środowiska zewnątrzkomórkowego. Wykorzystują w tym celu miejsca bezpośredniego kontaktu sąsiadujących komórek lub różnego rodzaju połączenia międzykomórkowe. Dzięki takiej bezpośredniej drodze transmisji wirusy mogą rozprzestrzeniać się szybciej i unikają kontaktu z przeciwciałami i komórkami układu immunologicznego. Dla niektórych wirusów posiadających osłonkę (np. wirusa HIV, wirusa odry i ludzkiego wirusa białaczki ) pokazano, że ten typ ukrytej szybkiej transmisji wirusa (ang.”cell-to-cell spread”) może stanowić ponad 60% infekcji. Uważa się, ze celowane hamowanie bezpośredniej transmisji międzykomórkowej wirusów stwarza nowe, znaczące możliwości terapeutyczne, szczególnie w chorobach neurologicznych.
 Naszym obiektem badań są głównie herpeswirusy, które po pierwotnym zakażeniu zostają w organizmie gospodarza na całe życie w stanie tzw. latencji (utajenia) i mogą się wielokrotnie reaktywować, co oznacza, że ukrywanie się przed odpowiedzią immunologiczną gospodarza (wywołaną w czasie pierwotnej infekcji) jest dla tych wirusów szczególnie ważne. Ok. 80% populacji ludzkiej jest zakażone w sposób chroniczny co najmniej dwoma wirusami z tej rodziny, takimi jak wirus opryszczki (HSV-1) i wirus cytomegalii (CMV), choć najczęściej u większości ludzi ta infekcja ma charakter utajony i nie powoduje objawów choroby. Szczepy herpeswirusowe o upośledzonej zdolności do „cell-to-cell spread” są całkowicie „niezjadliwe” i wykorzystuje się je jako szczepionki przeciw herpeswirusom zwierzęcym. Dotychczas jednak nie ma takich szczepów dla ludzkich herpeswirusów. Drugim modelem badawczym był wirus zapalenia wątroby typu C (HCV), jeden z najgroźniejszych patogenów człowieka, który w bardzo ograniczonym zakresie może być hodowany w laboratorium i jest niezwykle zmienny, w związku z czym wciąż nie ma przeciwko niemu szczepionki. Proces wnikania HCV do komórek jest coraz lepiej poznawany, choć daleko jest do jego pełnego zrozumienia. Dopiero niedawno odkryto, że ten wirus również może przenosić się bezpośrednio z komórki do komórki, bez wydostawania się na zewnątrz.
Naszym obiektem badań są głównie herpeswirusy, które po pierwotnym zakażeniu zostają w organizmie gospodarza na całe życie w stanie tzw. latencji (utajenia) i mogą się wielokrotnie reaktywować, co oznacza, że ukrywanie się przed odpowiedzią immunologiczną gospodarza (wywołaną w czasie pierwotnej infekcji) jest dla tych wirusów szczególnie ważne. Ok. 80% populacji ludzkiej jest zakażone w sposób chroniczny co najmniej dwoma wirusami z tej rodziny, takimi jak wirus opryszczki (HSV-1) i wirus cytomegalii (CMV), choć najczęściej u większości ludzi ta infekcja ma charakter utajony i nie powoduje objawów choroby. Szczepy herpeswirusowe o upośledzonej zdolności do „cell-to-cell spread” są całkowicie „niezjadliwe” i wykorzystuje się je jako szczepionki przeciw herpeswirusom zwierzęcym. Dotychczas jednak nie ma takich szczepów dla ludzkich herpeswirusów. Drugim modelem badawczym był wirus zapalenia wątroby typu C (HCV), jeden z najgroźniejszych patogenów człowieka, który w bardzo ograniczonym zakresie może być hodowany w laboratorium i jest niezwykle zmienny, w związku z czym wciąż nie ma przeciwko niemu szczepionki. Proces wnikania HCV do komórek jest coraz lepiej poznawany, choć daleko jest do jego pełnego zrozumienia. Dopiero niedawno odkryto, że ten wirus również może przenosić się bezpośrednio z komórki do komórki, bez wydostawania się na zewnątrz.
Nasze metody badawcze to konstrukcja mutantów wirusowych, modyfikacja genów zaangażowanych w transmisję międzykomórkową, badanie ich oczyszczonych produktów oraz analiza wzajemnych oddziaływań i ważnych funkcjonalnie domen. Ważnym podejściem eksperymentalnym jest bezpośrednia obserwacja poruszania się wirusów w żywych komórkach, możliwa dzięki użyciu znakowanych fluorescencyjnie „świecących” wirusów, które konstruujemy w naszym laboratorium. Dzięki tej metodzie udało się m.in. pokazać, że herpeswirusy mogą przemieszczać się pomiędzy odległymi od siebie komórkami poprzez długie i cienkie wypustki, „nanorurki” (tunneling nanotubes), czyli specjalistyczne mostki, które zidentyfikowano w ostatnich latach. Co więcej, pokazaliśmy, że obecność wirusa stymuluje powstawanie takich połączeń międzykomórkowych i że zaangażowana jest w ten proces jedna z kinaz wirusowych. Było to ważne odkrycie, gdyż dotychczas ten sposób transportu był zaobserwowany tylko dla wirusa HIV i niektórych RNA wirusów. Wyniki tej pracy zostały opublikowane w Journal of Virology (DOI: 10.1128/JVI.00090-18).
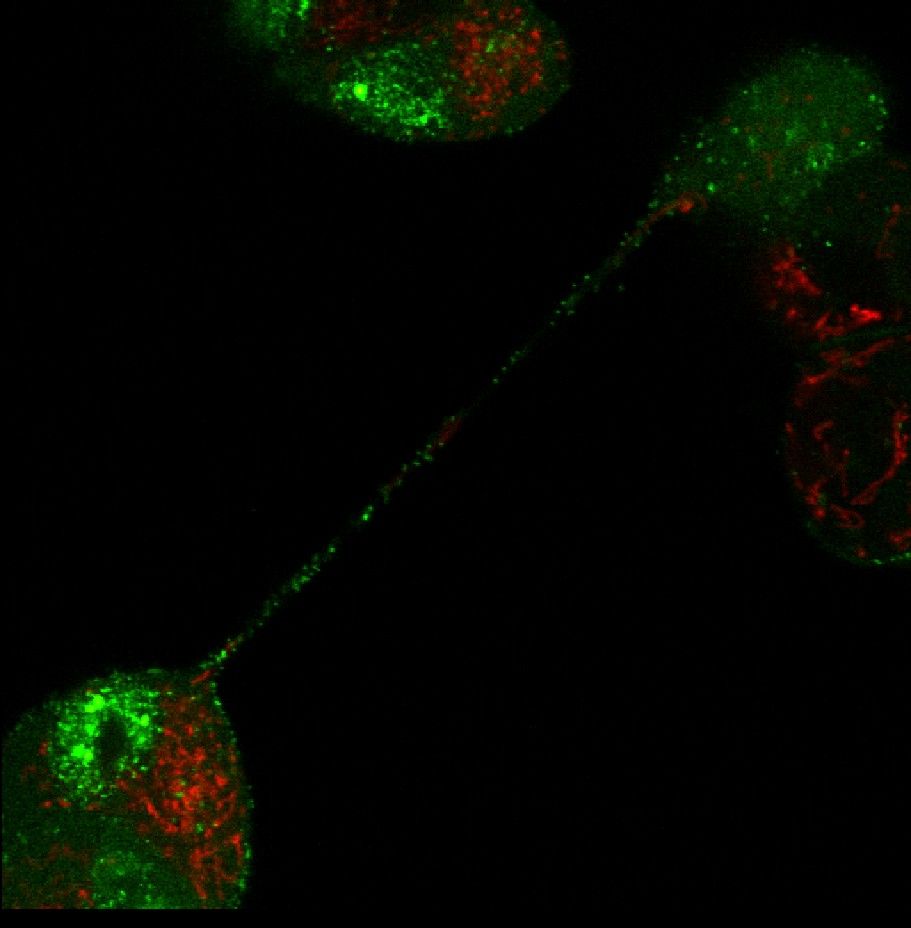 Transport znakowanych (zielonych) cząsteczek wirusa BHV-1 przez połączenia międzykomórkowe typu nanorurki. Marker zielony: GFP związany z kapsydem wirusa, marker czerwony − mitochondria
Zidentyfikowaliśmy niektóre białka komórkowe oddziałujące bezpośrednio z glikoproteiną gE, osłonkowym białkiem herpeswirusa zwierzęcego (BHV-1) niezbędnym do szybkiego przemieszczania się wirusów z tej grupy. Opracowaliśmy nowe metody pomiaru szybkości ich przemieszczania się wirusów drogą cell-to-cell, a wyniki naszych badań wskazują, że jest to droga bardzo często wykorzystywana w przebiegu naturalnej infekcji. Szczególnie interesuje nas bardzo słabo zbadane zagadnienie transportu wirusów pomiędzy komórkami różnego pochodzenia (np. komórkami nabłonkowymi wyścielającymi narządy zainfekowane przez wirusy), a komórkami krwi. Lepsze poznanie mechanizmów molekularnych związanych z szybkim rozprzestrzenianiem się wirusów pomiędzy komórkami może mieć wielkie znaczenie dla opracowania nowych metod kontroli infekcji wirusowych. Kontynuacją tych badań jest poszukiwanie metod transportu międzykomórkowego koronawirusów. Dotychczas jest bardzo niewiele wstępnych doniesień na temat przenoszenia wirusów z tej rodziny drogą „uproszczonej” szybkiej transmisji Biorąc pod uwagę ogromną wydajność infekcji SARS-CoV2 oraz różnorodność organów – płuca, ale także jelita, nerki, serce – które mogą ulec zakażeniu, można założyć, że ten wirus także wykorzystuje taki sposób przemieszczania się w organizmie. Te badania są tematem następnego projektu NCN, prowadzonego w ramach Preludium-bis. W ramach tego projektu poszukujemy ukrytych dróg transportu koronawirusów pomiędzy bliskimi i odległymi komórkami. Badania rozpoczęto na modelu mysiego koronawirusa MHV, skupiając się na transmisji wirusa pomiędzy rożnego typu komórkami zakażonymi i niezakażonymi poprzez połączenia międzykomórkowe. Obecnie ukończone zostały prace nad adaptacją naszego laboratorium do poziomu bezpieczeństwa wymaganego dla SARS-CoV 2, co umożliwia prowadzenie pracy eksperymentalnej z ludzkimi koronawirusami. Nasze doświadczenie i techniki badawcze, opracowane podczas realizacji projektu MAESTRO są obecnie wykorzystywane do badań nad wirusem SARS-CoV2.
Transport znakowanych (zielonych) cząsteczek wirusa BHV-1 przez połączenia międzykomórkowe typu nanorurki. Marker zielony: GFP związany z kapsydem wirusa, marker czerwony − mitochondria
Zidentyfikowaliśmy niektóre białka komórkowe oddziałujące bezpośrednio z glikoproteiną gE, osłonkowym białkiem herpeswirusa zwierzęcego (BHV-1) niezbędnym do szybkiego przemieszczania się wirusów z tej grupy. Opracowaliśmy nowe metody pomiaru szybkości ich przemieszczania się wirusów drogą cell-to-cell, a wyniki naszych badań wskazują, że jest to droga bardzo często wykorzystywana w przebiegu naturalnej infekcji. Szczególnie interesuje nas bardzo słabo zbadane zagadnienie transportu wirusów pomiędzy komórkami różnego pochodzenia (np. komórkami nabłonkowymi wyścielającymi narządy zainfekowane przez wirusy), a komórkami krwi. Lepsze poznanie mechanizmów molekularnych związanych z szybkim rozprzestrzenianiem się wirusów pomiędzy komórkami może mieć wielkie znaczenie dla opracowania nowych metod kontroli infekcji wirusowych. Kontynuacją tych badań jest poszukiwanie metod transportu międzykomórkowego koronawirusów. Dotychczas jest bardzo niewiele wstępnych doniesień na temat przenoszenia wirusów z tej rodziny drogą „uproszczonej” szybkiej transmisji Biorąc pod uwagę ogromną wydajność infekcji SARS-CoV2 oraz różnorodność organów – płuca, ale także jelita, nerki, serce – które mogą ulec zakażeniu, można założyć, że ten wirus także wykorzystuje taki sposób przemieszczania się w organizmie. Te badania są tematem następnego projektu NCN, prowadzonego w ramach Preludium-bis. W ramach tego projektu poszukujemy ukrytych dróg transportu koronawirusów pomiędzy bliskimi i odległymi komórkami. Badania rozpoczęto na modelu mysiego koronawirusa MHV, skupiając się na transmisji wirusa pomiędzy rożnego typu komórkami zakażonymi i niezakażonymi poprzez połączenia międzykomórkowe. Obecnie ukończone zostały prace nad adaptacją naszego laboratorium do poziomu bezpieczeństwa wymaganego dla SARS-CoV 2, co umożliwia prowadzenie pracy eksperymentalnej z ludzkimi koronawirusami. Nasze doświadczenie i techniki badawcze, opracowane podczas realizacji projektu MAESTRO są obecnie wykorzystywane do badań nad wirusem SARS-CoV2.
Pełny tytuł finansowanego projektu: Mechanizmy rozprzestrzeniania się wirusów pomiędzy komórkami: wirusowe strategie przetrwania
prof. dr hab. Krystyna Bieńkowska-Szewczyk
Kieruje Zakładem Biologii Molekularnej Wirusów na Międzyuczelnianym Wydziale Biotechnologii Uniwersytetu Gdańskiego i Gdańskiego Uniwersytetu Medycznego. Jest absolwentką Uniwersytetu Gdańskiego. W czasie pierwszych lat pracy zajmowała się biologią molekularną bakteriofagów i tej tematyki dotyczyła jej praca doktorska na Wydziale Biologii UG oraz staż podoktorski w University of San Francisco w Kalifornii. Podczas następnego stażu doktorskiego, pracując nad mechanizmem translacji poliowirusa w University of Utah (Salt Lake City, USA), zainteresowała się wirusami ludzkimi. Po powrocie do Polski stworzyła wraz z mężem, prof. Bogusławem Szewczykiem, nowoczesne laboratorium wirusologii molekularnej na Uniwersytecie Gdańskim, w którym obiektem badań są wirusy takie jak alfa-herpeswirusy, wirus zapalenia wątroby typu C, wirus grypy i liczne patogeny zwierzęce. W laboratorium używa się też innych wirusów, takich jak bakulowirus owadzi, retrowirusy i adenowirusy do ekspresji obcych genów i konstrukcji wektorów wirusowych. Grupa współpracuje z wieloma ośrodkami zagranicznymi, m.in. z Institute for Animal Health w Holandii i Instytutem Wirusologii w MRC w Glasgow. Prof. Bieńkowska-Szewczyk kierowała licznymi grantami naukowymi, była kierownikiem grupy partnerskiej w pięciu międzynarodowych projektach finansowanych z kolejnych Programów Ramowych UE. Wielokrotnie pełniła funkcję eksperta w programach Komisji Europejskiej. W 2011 r. została wyróżniona pełnieniem roli gospodarza prestiżowego kongresu naukowego International Herpeswirus Workshop, który odbył się w Gdańsku, a w 2023 r. będzie gospodarzem European Congress of Virology, największej konferencji wirusologicznej w Europie. Jest autorką ok. 56 publikacji w międzynarodowych czasopismach takich jak Journal of Virology, Virology, PNAS, Oncogene, Vaccine, Euro Surveill. Z jej inicjatywy w ramach programu Międzynarodowe Agendy Badawcze FNP powstało przy Uniwersytecie Gdańskim Międzynarodowe Centrum Badań nad Szczepionkami Przeciwnowotworowymi. W trakcie pandemii koronawirusa prof. Bieńkowska-Szewczyk aktywnie zaangażowała się w organizację diagnostyki SARS-CoV2, a następnie w prace nad badaniem sekwencji genetycznych wirusa. Była członkiem powołanego przez Ministra Nauki i Szkolnictwa Wyższego Zespołu doradczego do spraw działań związanych z zapobieganiem, przeciwdziałaniem i zwalczaniem COVID-19. Prowadziła bardzo aktywna działalność popularyzatorską w zakresie informowania o wirusie, przebiegu pandemii i propagowania szczepień przeciwko Covid-19. Za tę działalność medialną została uhonorowana przez dziennikarzy tytułem Pomorzanki roku 2021.